Кислотность почвы (рН)
Кислотность почвы — способность почвы проявлять свойства кислот.
Наличие ионов водорода (Н-ионов) в почвенном растворе, а также обменных ионов водорода и алюминия в почвенном поглощающем комплексе при неполной нейтрализации придаёт почве кислую реакцию.
wikipedia.org
Почвенный поглощающий комплекс
Поверхность частиц глины и органическое вещество несут отрицательный заряд и могут притягивать к себе положительные ионы (катионы) водорода, (H+), кальция (Ca2+), магния (Mg2+), калия (K+), натрия (Na+) и др. Сумма коллоидных частиц почвы, определяющих её способность удерживать питательные вещества, называется грунтовым поглощающим комплексом.
Кальций, магний, калий и натрий могут вытеснять ионы водорода, снижая кислотность. Поэтому щелочными могут быть не только почвы, где много извести (кальция), но и засоленные почвы, имеющие избыток натрия.
Кислотность большинства почв обусловлена сосредоточением катионов на поверхности мелких частиц глины. Именно на поверхности этих мелких частиц почвы удерживаются питательные элементы и от размера суммарной поверхности этих частиц зависят свойства почвы и ее плодородие.
Что такое pH
Определение реакции почвы относится к числу наиболее распространенных анализов. Реакция среды (рН) зависит от содержания ионов водорода (Н+) и служит показателем кислотности или щелочности почвы. Этот показатель зависит в основном от ионного обмена с минеральными и органическими коллоидами и наличия карбонатов кальция, натрия, калия и других катионов. Реакция среды почвы варьируется от 5,0 (сильнокислая) – 7,0 (нейтральная) – до 9,0 (сильнощелочная). С повышением рН возрастает возможность образования нерастворимых гидроксидов и карбонатов.
Кислотность почв обусловлена многими факторами, одним из которых является диссоциация функциональных групп гумуса, а другим – микробиологическое разложение органического вещества. Остальными источниками кислотности почв служат глинисто-силикатные минералы и гидроксиды железа и алюминия. Интенсивность подкисления почв в определенной степени зависит от равновесия между ионами водорода и алюминия.
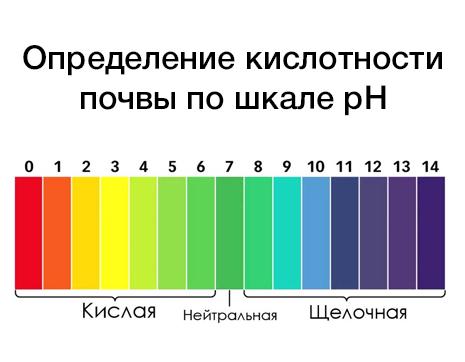
При сильном подкислении почв снижается жизнедеятельность многих микроорганизмов. Кислотность выражается в единицах от 0 до 14: рН = — lg [H+] Значение pH 7.0 означает нейтральную реакцию, выше – щелочную, ниже – кислую. Уменьшение pH на единицу означает увеличение кислотности почвы в 10 раз.
| pH | Концентрация ионов водорода | Реакция почвы | Простые вещества |
|---|---|---|---|
| 3 | 10-3 | Очень сильная кислотность | Лимонный сок |
| 4 | 10-4 | Сильная кислотность | Апельсиновый сок |
| 5 | 10-5 | Умеренная кислотность | |
| 6 | 10-6 | Слабая кислотность | Молоко |
| 7 | 10-7 | Нейтральная | Дистиллированная вода |
| 8 | 10-8 | Слабая щелочность | Морская вода |
| 9 | 10-9 | Умеренная щелочность | Мыльный раствор |
| 10 | 10-10 | Сильная щелочность | |
| 11 | 10-11 | Очень сильная щелочность |
Образование ионов водорода ионов (H+) происходит при растворении в грунтовой воде углекислого газа (CO2) и образовании угольной кислоты. Углекислый газ выделяется корнями живых растений при дыхании, а также при распаде органических веществ (или органических удобрений).
Ионы водорода могут вытеснять в грунтовый раствор минеральные катионы. Более того, ионы кальция, магния, калия и натрия, находятся в постоянном движении между грунтовыми частицами, почвенным раствором и корнями растений. Наполнение кальция, магния, калия и натрия происходит за счет распада минеральных грунтовых частиц и внесения органических и минеральных удобрений. Высокий уровень катионного обмена характерен для глинистых и органических почв, низкий – для песчаных. Соответственно, песчаные почвы чаще бывают кислыми, чем щелочными. И наоборот: глинистые почвы чаще бывают щелочными, чем кислыми.
Предостережение
При внесении большого количества одного катиона, другие могут быть вытеснены в грунтовой раствор и вымыты в глубокие слои почвы. Это может происходить при внесении большого количества несбалансированного минерального удобрения. Особенно это опасно на легких песчаных почвах, поэтому дозы минеральных удобрений там снижают, разбивая на несколько взносов.
От чего зависит кислотность почвы?
В общем, кислые почвы характерны для районов, где количество осадков достаточно высоко. Дождь и снег повышают количество влаги в почве и концентрация кальция и магния в почвенном растворе снижается. Ионы кальция и магния из частиц почвы переходят в грунтовый раствор и, в конечном счете, вымываются из почвы. Их место на частицах почвы занимают ионы водорода H+, почва подкисляется и требуется повторное внесение извести.
Но что же в природных условиях повышает кислотность почвы и делает её более кислой? В местах, где количество осадков превышает 500 мм/год, происходят значительные ежегодные потери кальция из-за вымывания. Приблизительно такое же количество кальция выносится из почвы с высоким урожаем. В случае щелочных и сильнощелочных почвах (рН > 8,0) часто возникает вопрос: Как понизить уровень рН почвы? Или как понизить щелочность почвы? Внесение минеральных удобрений, например сульфата аммония или элементарной серы, также может подкислять почву.
Углекислый газ, растворенный в грунтовой воде, является мощным растворителем соединений кальция, переводя, в частности, нерастворимый карбонат кальция CaCO3 в растворимый бикарбонат кальция Ca(HCO3)2. При возрастании активности почвенных микроорганизмов в почву выделяется много углекислого газа, что ведет к потерям кальция из-за вымывания его из почвы в виде бикарбоната.
Почему важна кислотность почвы
Чрезмерно высокий (выше 9,0) или низкий (ниже 5,0) уровень кислотности почвы токсичен для корней растений. В пределах этих значений pH определяет поведение отдельных питательных веществ, осаждение их или превращение в недоступные растениям формы. В кислых почвах железо, алюминий и марганец находятся в формах доступных растениям, а их концентрация достигает токсического уровня. При этом затрудняется поступление в растения фосфора, калия, серы, кальция, магния, молибдена.
На кислой почве может наблюдаться гибель растений без внешних причин (гибель от мороза, развитие болезней и вредителей). Напротив, в щелочных почвах железо, марганец, фосфор, медь, цинк и бор становятся менее доступными растениям из-за образования нерастворимых гидроксидов. Оптимальным считается pH ~ 6,5 (слабокислый – близкий к нейтральному уровень рН), при которой большинство основных питательных веществ будут доступны растениям.
Как говорилось выше, pH ~ 6,5 будет являться благоприятной средой для развития полезных почвенных микроорганизмов, обогащающих почву азотом. Хотя отдельные виды растений приспособились к существованию в кислой или наоборот в щелочной среде, однако большинство растений хорошо развиваются при нейтральной или слабокислой реакции почвы (pH 6.0-7.0).
Оптимальные значения рН почвы для основных сельскохозяйственных культур
| Растение | Оптимальное значение рН | Растение | Оптимальное значение рН |
| Овёс | 5.0-7.7 | Картофель | 5.0-5.5 |
| Рожь озимая | 5.5-7.5 | Сахарная свекла | 7.0-7.5 |
| Пшеница яровая | 6.0-7.5 | Люцерна | 7.0-8.0 |
| Пшеница озимая | 6.3-7.6 | Клевер | 6.0-7.0 |
| Ячмень | 6.8-7.5 | Капуста | 6.7-7.4 |
| Кукуруза | 6.0-7.0 | Столовая свекла | 6.8-7.5 |
| Просо | 5.5-7.5 | Помидоры | 6.3-6.7 |
| Гречиха | 4.7-7.5 | Редис | 5.5 та вище |
| Горох | 6.0-7.0 | Морковь | 5.5-7.0 |
| Соя | 6.5-7.1 | Огурец | 6.0-7.9 |
| Горчица | ~ 7.0 | Салат | 6.0-7.0 |
| Лен | 5.9-6.5 | ||
| Подсолнечник | 6.0-6.8 | ||
| калий для растений | простейшие микроорганизмы | агротест |
| кислотність грунту | фосфор в почве | аналіз грунту |
| азот для растений | калій для рослин | mechanical composition of soil |
| листовая диагностика растений |
Напишите нам
и мы найдем возможность
для сотрудничества


